Eletrólise em solução aquosa
Uma substância qualquer pode gerar íons em solução aquosa. Neste caso, os íons que podem vir a sofrer eletrólise podem se originar dessa substância ou da própria auto-ionização da água. Apesar da auto-ionização da água ocorrer em baixa extensão, ela oferece esta possibilidade de um ou outro íon vir a se descarregar.
Apenas uma espécie de íon positivo ou negativo descarrega por vez. Cada íon possui uma voltagem adequada para se descarregar. O par cátion/ânion de apresentar menor voltagem para descarregar será o que vai descarregar primeiro.
A auto-ionização da água fornece os íons H1+ (H3O1+) e OH1-.
H20 => H1+ + OH1-
ou ainda
2 H2O => H2O + H1+ + OH1- => H3O1+ + OH1-
No caso dos cátions, metais pouco reativos descarregam primeiro, pois possuem maior tendência a aceitar os eletrons de volta e se descarregar. Metais altamente reativos como metais alcalinos e alcalino terrosos se descarregam depois. A ordem de prioridade é a seguinte:

O H1+ ou H3O1+ se descarrega antes alumínio, de metais alcalinos e alcalinos terrosos. Mas perde em prioridade de descarga para os demais cátions.
Quanto menor for a eletronegatividade do ânion para prender o elétron, maior a facilidade de descarga do mesmo.

O OH1- se descarrega antes dos ânions oxigenados e do F1-. Mas perde em prioridade de descarga para os ânions não oxigenados e o HSO41-. As reações que os íons resultantes da auto-ionização da água são mostradas abaixo:
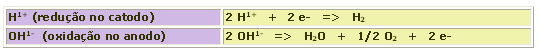
A eletrólise do NaCl em solução aquosa é um exemplo em que participam da eletrólise o cátion oriundo da auto-ionização da água e o ânion do sal.
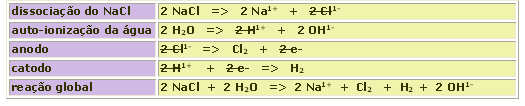
Nota-se pela reação global que a eletrólise do NaCl é método de obtenção de H2, Cl2 e de soda cáustica (NaOH).
Na eletrólise do HCl, somente os íons do soluto participam da eletrólise. Isto ocorre pelo fato de ambos os íons oriundos do soluto apresentarem prioridade de descarga em relação aos íons gerados pela auto-ionização da água.

O pH da solução se torna progressivamente mais alcalino já que o HCl é consumido na eletrólise.
Na eletrólise do Zn(NO3)2 em solução aquosa, participam da eletrólise o ânion oriundo da auto-ionização da água e o cátion do sal.

O pH da solução diminui, já que os íons H1+ gerados pela auto-dissociação da água não são consumidos na eletrólise.
Na eletrólise do Na2SO4 em solução aquosa, ambos os íons oriundos da dissociação da água têm prioridade na eletrólise.
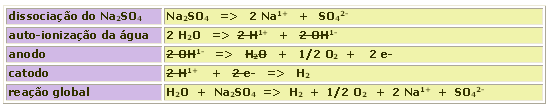
Como as moléculas de água são consumidas na eletrólise, a solução vai ficando progressivamente mais concentrada em sulfato de sódio.







