Hidretos
Resumo sobre Hidretos
Os hidretos são compostos orgânicos que, na molécula, apresentam o hidrogênio como o elemento mais eletronegativo. Esse grupo pode ser classificado de acordo com o tipo de ligação química que estabelecem: iônicos, covalentes e metálicos.
Os Hidretos iônicos apresentam o hidrogênio ligado a metais alcalinos e alcalinos terrosos. Geralmente são caracterizados por compostos sólidos e cristalinos. Como exemplos temos o Hidreto de sódio (NaH) e o Hidreto de cálcio (CaH2).
Já os Hidretos covalentes são aqueles formados pela junção do hidrogênio aos elementos dos grupos 3A (13), 4A (14), 5A (15), 6A (16) e 7A (17) e o berílio (Be), da Tabela Periódica. São exemplos o Hidreto de fósforo (PH3) e o Hidreto de enxofre (H2S).
E por último, temos os Hidretos metálicos, que são formados por hidrogênio combinado com elementos do bloco d e f da tabela periódica, lantanídeos e actinídeos. Como exemplo temos o Hidreto de antimônio (SbH3).
São compostos que possuem o hidrogênio como o elemento mais eletronegativo
O nome de um hidreto é formado segundo o esquema abaixo
Hidreto + de + nome do elemento
KH hidreto de potássio (iônico)…………….ASH3 hidreto de arsênio (covalente);
CAH2 hidreto de cálcio ( iônico)……………SIH4 hidreto de silício (covalente)
Os hidretos metálicos reagem com água de modo violento, liberando gás hidrogênio H2(g) e formando uma base do metal.
EX: 1KH + 1H2O___ 1KOH + 1H2 (g)
1CAH2 + 2H2O ___ 1CA (OH)2+ 2H2 (g)
As Propriedades dos Hidretos
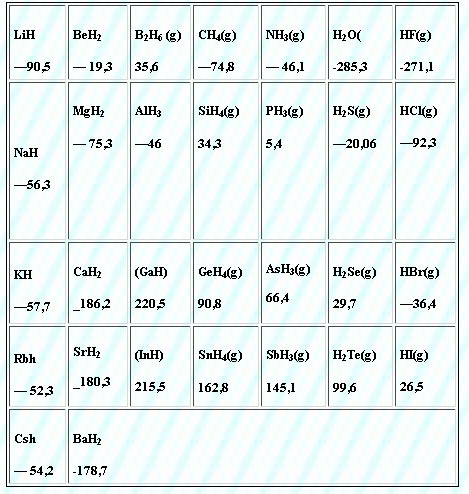
As fórmulas e entalpias padrão de formação de alguns hidretos dos elementos representativos estão mostradas na tabela.
A linha demarcatória separa, de maneira aproximada, os hidretos estáveis, dos hidretos instáveis termodinamicamente. Se olharmos novamente para as eletronegatividades de Pauling, poderemos ver que os hidretos instáveis são formados com os elementos cujas eletronegatividade são próximas das do hidrogênio. A molécula de hidrogênio apresenta ligação simples, tal que, ao contrário do O2 , nenhuma diferença extra de eletronegatividade é necessária para justificar sua energia de ligação. O fato que alguns hidretos apresentam positivos se deve à estabilidade dos elementos no estado padrão.
Entalpias Padrões de Formação de Alguns Hidretos
Existe apenas uma pequena diferença de eletronegatividade entre hidrogênio e muitos elementos; porém todos formam ligações com o hidrogênio. O boro e o hidrogênio formam uma ligação B -H com uma energia de ligação relativamente alta:
B—H(g) B(g) + H(g) D0 = 295,1 KJ mol –1
Os hidretos instáveis mostrados na tabela não apresentam estabilidade extra em suas ligações para superar a estabilidade do elemento no estado padrão. Enquanto o N2 tem uma ligação tripla com estabilidade extra, as três ligações N-H são suficientemente fortes para fazer do NH3 uma molécula termodicamente estável. Na tabela de Pauling, o hidrogênio e o nitrogênio tem eletronegatividade suficientemente diferentes para justificar a estabilidade extra da ligação N-H. Para o PH3 , ASH3 e SbH3 , a estabilidade das ligações com hidrogênio não é suficiente para superar a estabilidade extra do fósforo, arsênio e antimônio no estado padrão. Uma diferença de eletronegatividade 0.5 unidades é suficiente para estabilizar a maioria dos hidretos com relação aos elementos no estado padrão. Para o CH4 , mesmo uma diferença de 0.4 unidades já proporciona uma maior estabilidade em relação ao grafite e ao H2(g).
Com base nas propriedades químicas e físicas, incluindo estrutura, é possível classificar todos os hidretos como sendo iônicos, covalentes e de metais de transição. Os compostos de hidrogênio com os metais alcalinos e alcalinos-terrosos podem ser preparados pela combinação direta dos elementos em temperaturas elevadas, e constituem sólidos brancos, cristalinos. Quando algum desses hidretos for dissolvido em sais fundidos no anodo. Isto indica que o íon H está presente na mistura. As como, como LiCl e KCl, e depois eletrolisado, haverá desprendimento de hidrogênio medidas espectroscópicas têm mostrado que a molécula de hidreto de lítio gasoso é muito polar, onde o átomo de hidrogênio tem uma carga negativa. Os dados espectroscópicos disponíveis indicam que os hidretos dos grupos IA e IIA (1 e 2 ) contêm o íon hidreto, H. Por essa razão, esses compostos são denominados, com freqüência, Hidretos salinos.
É interessante comparar as energias de formação do íon hidreto com respeito aos valores correspondentes para o íon fluoreto:
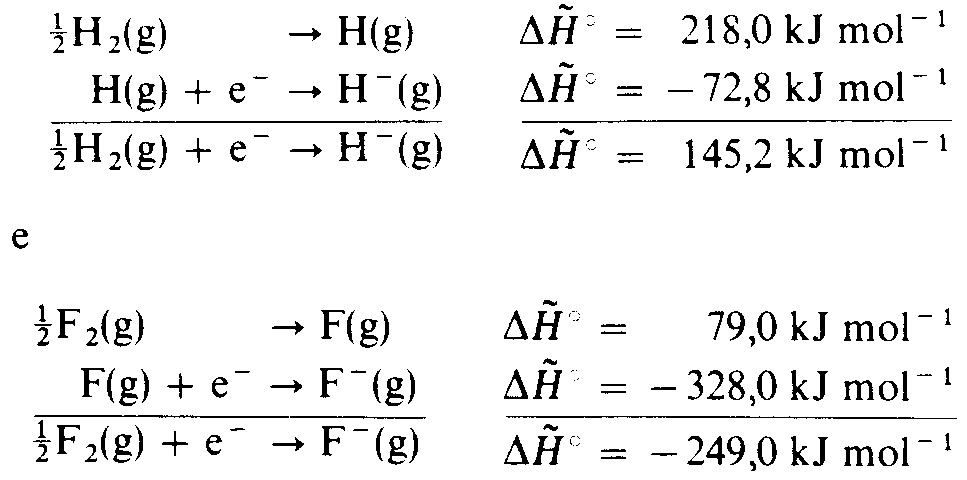
Portanto, a formação do íon hidreto, gasoso, a partir do H é um processo endotérmico, enquanto a formação do íon fluoreto,m ou qualquer dos outros íons haletos gasosos, constitui um processo exotérmico. Visto que a formação do íon hidreto é bastante desfavorável sob o ponto de vista termodinâmico, não causa surpresa os hidretos iônicos serem formados apenas com os elementos muito eletropositivos dos grupos IA e IIA (1 e 2). As energias de ionização dos outros elementos são bastante elevadas para evitar a transferência de seus elétrons para os átomos de hidrogênio.
A instabilidade relativa do íon hidreto sugere que os hidretos salinos sejam bons agentes redutores. De fato, reações do tipo
NaH + CO2 HCOONa
4NaH + Na2SO4 Na2S + 4NaOH
ocorrem, demonstrando o poder redutor do íon hidreto. Além disso, o íon hidreto reage de forma rápida e completa com a água, ou outro doador de próton, como em
CaH2 + 2H2O Ca(OH)2 + 2H2
Portanto, podemos considerar o íon hidreto como um poderoso agente redutor e uma base muito forte.
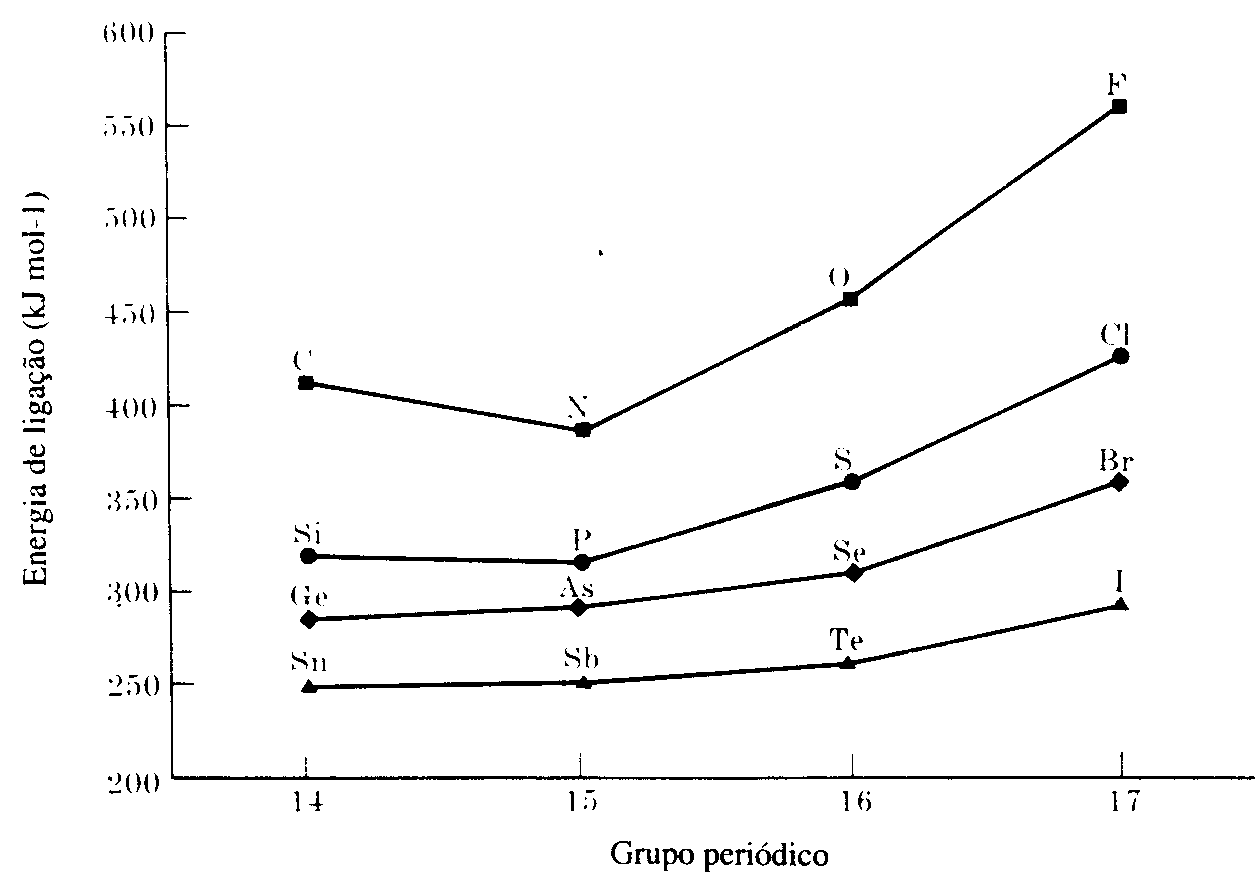
Os elementos representativos dos grupos IVA (14 a 17), e o boro, do grupo IIIA (13), forma hidretos moleculares voláteis, nos quais as ligações com o hidrogênio têm um caráter bastante covalente. Várias tendências nas propriedades desses hidretos covalentes tem sido constadas. Na figura pode ser visto que a energia da ligação H-X dos hidretos binários cresce ao longo de qualquer período da tabela periódica. Além disso, para uma dada família, a energia da ligação H-X diminui com o aumento do número atômico. Essas tendências nas energias de ligação ajudam explicar a instabilidade dos hidretos dos elementos mais pesados dos grupos IVA e VA(14 e 15). Os compostos PbH4 e BiH3 são tão instáveis que só tem sido detectados em nível de traços.
Os hidretos iônicos constituem bases fortes. Ao longo de um dado período da tabela periódica, os hidretos covalentes apresentam acidez crescente com o aumento no número atômico. Assim, o CH4 quase não tem propriedades ácidas, porém o NH3 é capaz de doar um próton para uma base forte, formando NH2 ; o H2O perde prótons com bastante facilidade, e o HF é um ácido moderadamente forte. Essa tendência na acidez aparece de novo nos períodos seguintes da tabela periódica. Além disso, a acidez dos hidretos dos grupos VIA e VIIA (16 e 17) aumenta ã medida que descemos ao longo dessas famílias.
Enquanto os hidretos dos não-metais são compostos moleculares bem caracterizados, pouco se sabe sobre os hidretos de metais de transição. Muitos desses hidretos tem composição não_estequiométrica. O titâno e o vanádio metálico absorvem hidrogênio com liberação de calor, porém o arranjo dos átomos metálicos na estrutura permanece quase constante, com apenas um ligeiro aumento na distância entre os vizinhos mais próximos.
Assim o hidrogênio parece ocupar posições intersticiais na rede cristalina, de forma que esses compostos são chamados algumas vezes de hidretos intersticiais. Não está claro em muitas substâncias se os hidretos intersticiais devem ser considerados como compostos verdadeiros ou então soluções de hidrogênio no metal. Apesar da falta geral de conhecimento sobre a natureza dos sistemas formados pelo hidrogênio e os metais de transição , muitos deles são importantes no laboratório. O níquel, platina e o paládio absorvem quantidade variáveis de hidrogênio e nessa condição atuam como catalisadores de reações como
H2 + C2H4 C2H2 Pt, Pd,Ni
onde o Hidrogênio se adiciona a outras moléculas.
Os hidretos de berílio, magnésio e alumínio, e dos elementos mais pesados do grupo IIIA (13) constituem sólidos não-voláteis, que parecem ter propriedades intermediárias entre as dos hidretos iônicos e as dos hidretos moleculares covalentes.
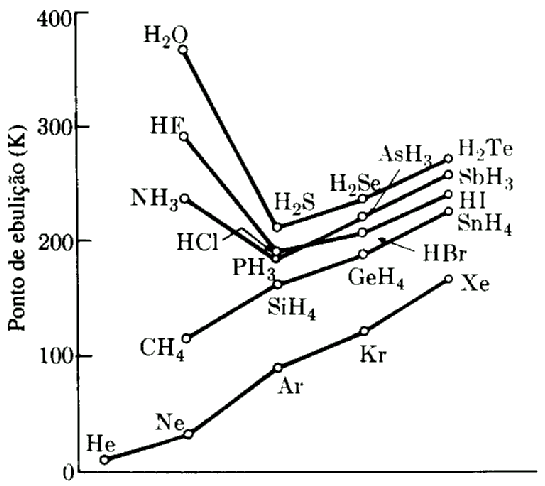
Existem também as tendências nos pontos de ebulição dos diversos haletos covalentes. Note que as temperaturas de ebulição do hélio e neônio são muito menores que as do criptônio e xenônio. Esses gases nobres são mantidos no estado líquido por meio de forças de van der Waals, que ficam mais fracas quando o número de elétrons diminui. As temperaturas de ebulição do NH3, HF e H2O são maiores que a dos hidretos situados abaixo na tabela periódica. Esses hidretos no estado líquido apresentam pontes de hidrogênio intermolecular relativamente fortes e que são maiores para os elementos mais leves da série. O fato do H2O apresentar a temperatura de ebulição mais elevada indica que a extensão das pontes de hidrogênio é máxima, dentro da série.