Saponificação
A saponificação trata-se da hidrólise alcalina de ésteres provenientes de ácidos graxos. A reação é assim denominada porque o sal que é formado dessa reação recebe o nome de sabão. Ela ocorre quando um éster em solução aquosa de base inorgânica original um sal orgânico e álcool.
A reação de saponificação também é conhecida como hidrólise alcalina, sendo possível através dela, o feitio do sabão. Quimicamente falando, seria uma mistura de um éster, proveniente de um ácido graxo e uma base, hidróxido de sódio, com a finalidade de se obter o sabão, um sal orgânico.
A equação abaixo demonstra este processo:
Éster + base forte + sabão + glicerol
Praticamente, todos os ésteres são retirados de óleos e gorduras, por isso muitas donas de casa utilizam a o óleo comestível para a confecção de sabão caseiro.
Os ácidos graxos são ácidos carboxílicos de cadeia longa, geralmente contem 12 átomos de carbono ou mais. Eles entram em reação com a glicerina (glicerol ou propanotrial), formando os glicerídeos, também conhecidos como triglicerídeos ou triacilgliceróis, que são as substâncias que compõem os óleos e as gorduras animais e vegetais.
Com isso, o sabão é produzido por meio do aquecimento de óleos e ou gorduras vegetais em uma solução aquosa de uma base forte, como o hidróxido de sódio, conhecido popularmente como soda cáustica.
Como eram feitos os sabões antigamente?
Antigamente, os primeiros sabões produzidos, eram feitos com misturas de gorduras de animais (sebo), como o material graxo, com as cinzas de madeira, que possuem substâncias alcalinas, como o carbonato de sódio e de potássio.
Observe que o sabão formado possui em sua estrutura uma longa cadeia proveniente do ácido graxo que constitui uma parte apolar, enquanto sua extremidade é polar. Isso faz com que a parte apolar interaja com as sujeiras gordurosas que também são apolares, enquanto a extremidade polar interage com a água, que também é polar. É dessa forma que o sabão consegue diminuir a tensão superficial da água, por isso são também chamados de agentes tensoativos ou de surfactantes, eliminando a sujeira. A parte apolar interage com a sujeira (por exemplo, gorduras) e a parte polar interage com a água, “aprisionando” a sujeira em pequenas partículas que são enxaguadas e arrastadas pelo processo de lavagem.
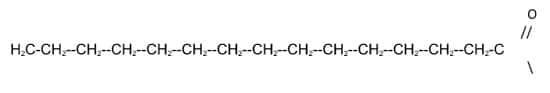
Os sabões produzidos com o hidróxido de sódio são mais duros. Já os produzidos com hidróxido de potássio (KOH) são mais moles ou até mesmo líquidos. Daí, surgiu o índice de saponificação, que é a quantidade em miligramas de KOH que é necessária para saponificar 1g de óleo ou de gordura.
Veja os exemplos abaixo:
Óleos e gorduras…………….Índice de saponificação (mg)
Manteiga……………………210 a 235
Banha de porco………………190 a 200
Óleo de algodão……………..190 a 200
Óleo de linhaça……………..190 a 195
Quanto maior é o índice de saponificação, menor é a massa molar do triglicerídeo. Na reação de saponificação de triglicerídeos, é produzida, além do sabão, a glicerina, que é aproveitada pela indústria para ser usada na fabricação de cosméticos, como cremes e sabonetes.







