Ligações Químicas
Por definição: Ligações químicas significa a junção de átomos para formarem moléculas. Podemos classificar as ligações químicas em: ligação covalente, ligação iônica, ligação metálica e ligação covalente dativa.
Teoria do Octeto: Um grande número de elementos adquire estabilidade eletrônica quando seus átomos apresentam oito elétrons na sua camada mais externa. Existem exceções para essa teoria como o Hidrogênio (H) e o Hélio (He), onde ambos se estabilizam com dois elétrons na última camada.
Ligações Iônicas ou Eletrovalentes:
Na ligação iônica há a formação de íons devido a transferência de elétrons de um átomo para o outro. Normalmente, nesta ligação, existe um elemento que tende a ceder elétrons (metal – cátion), e outro que tende a receber elétrons (não metal – ânion).
Obs: A ligação iônica é a única em que ocorre a transferência de elétrons.
Exemplo. A configuração eletrônica do Sódio e do Cloro segundo o diagrama de Linus Pauling fica do seguinte modo:
11Na 1s2 2s2 2p6 3s1
17Cl 1s2 2s2 2p6 3s2 3p5
O sódio possui 1 elétron na última camada. Basta perder este elétron para que ele fique estável com 8 elétrons na 2ª camada.
O cloro possui 7 elétrons na última camada. É bem mais fácil ele receber 1 elétron e ficar estável do que perder 7 elétrons para ficar estável, sendo isto o que acontece.
Agora tudo está perfeito. O sódio quer doar 1 elétron e o cloro quer receber 1 elétron. Eles se aproximam e o sódio doa seu elétron que está em excesso e o cloro o recebe. Veja o esquema abaixo:

Ligações Covalentes ou Molecular:
Ligação covalente ou molecular é aquela onde os átomos possuem a tendência de compartilhar os elétrons de sua camada de valência, ou seja, de sua camada mais instável. Neste tipo de ligação não há a formação de íons, pois as estruturas formadas são eletronicamente neutras.
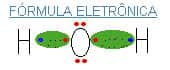
Note que há o compartilhamento de elétrons entre os átomos de hidrogênio e os de oxigênio. Os elétrons da nuvem eletrônica não pertencem exclusivamente ao hidrogênio nem ao oxigênio; pertencem aos dois átomos simultaneamente.
Ligações Covalentes Dativa ou Coordenada:
Este tipo de ligação ocorre quando os átomos envolvidos já atingiram a estabilidade com os oito ou dois elétrons na camada de valência.
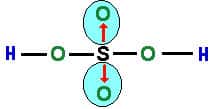
Note que as setas vermelhas indicam as ligações dativas; onde o átomo de enxofre “doa” um par de elétrons para cada átomo de oxigênio; e os traços indicam o compartilhamento de elétrons que ocorre normalmente entre o enxofre e o oxigênio.