Geometria Molecular
Para que seja possível determinar a geométrica molecular, é preciso escrever a fórmula da molécula, descobrir qual é o átomo central e ver quantas nuvens eletrônicas existem.
A geometria molecular tem como base a forma espacial que as moléculas assumem quando os átomos são ligados. Dessa forma, cada molécula apresenta uma forma geométrica característica da natureza das ligações, iônicas ou covalentes, e dos constituintes, como elétrons de valência e eletronegatividade.
Um dos modos que são mais utilizados para descobrir a geometria molecular, ou seja, qual é a forma que os átomos estão dispostos espacialmente em uma molécula, é pela teoria da repulsão dos pares eletrônicos, também chamada de teoria da repulsão dos pares de elétrons da camada de valência (RPECV).
Teoria da repulsão dos pares eletrônicos
Essa teoria considera as ligações covalentes que o átomo central realiza com os demais átomos como uma nuvem eletrônica. Cada par de elétrons disponível, ou seja, os elétrons de um átomo central que não estão envolvidos em nenhuma ligação, também forma uma nuvem eletrônica. As nuvens eletrônicas se afastam, pois são formadas de elétrons de cargas negativas, fazendo assim, com que a geometria da molécula seja definida, exatamente com o afastamento dos átomos.
Para melhor explicar o texto acima, imagine que cada nuvem é um balão. Isso ajudará a compreender melhor a teoria da repulsão dos pares eletrônicos.
Agora, imagine dois balões amarrados e que o nó no centro representa o átomo central. Com isso, você perceberá que os balões irão se afastar o máximo possível, porque seria como se um estivesse empurrando o outro. Esse mesmo efeito acontece com as nuvens eletrônicas dos átomos, que os afastam a fim que de possam adquirir a disposição espacial mais estável.
Dessa forma, para você conseguir determinar a geometria de uma molécula, faça o seguinte:
- Escreva a fórmula eletrônica de Lewis, na qual são escritos os símbolos dos elementos químicos e os elétrons da camada de valência ao seu redor (como pontinhos), e determine qual é o átomo central. Os pares de elétrons compartilhados devem ficar o mais distante possível um dos outros;
- Verifique quantas nuvens eletrônicas a molécula possui, e qual é a geometria da molécula.
Leia também: Ligação covalente
Importante ressaltar que essa determinação não é realizada para moléculas diatômicas, ou seja, aquelas que são formadas por dois átomos, HCI, HBr, H2,CO, entre outros, porque toda molécula diatômica é linear, ou seja, possui ângulo de 180º.
A geometria linear também pode ocorrer no caso de moléculas que possuem três átomos, onde o átomo central possui um dos seus pares eletrônicos não compartilhados. Como exemplo, o CS2.
A fórmula eletrônica do CS2 seria: C – S –C
Agora, a quantidade de nuvens eletrônicas. Veja o átomo central, Carbono, que tem duas ligações duplas, apresentando duas nuvens eletrônicas, numa distância máxima que forma um ângulo de 180º.
S = C = S – S = C = S
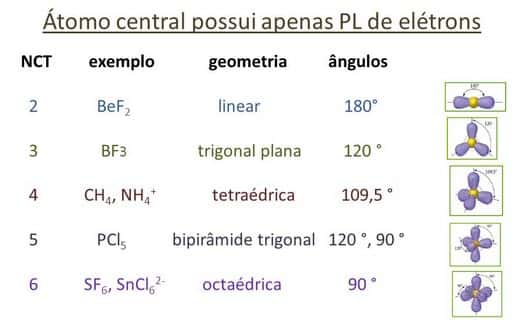
Assim sendo, as geometrias mais comuns obtidas são:
Linear
Triangular
Angular
Tetraédrica
Piramidal
Bipiramidal
Octaétrica
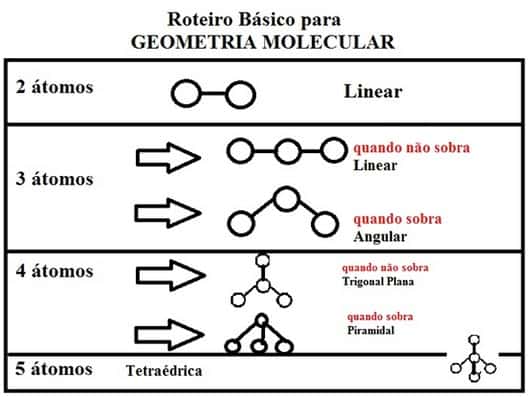
Importante lembrar que toda molécula biatômica assume geometria linear. Mas apenas as geometrias linear, triangular e angular são planas. As outras são espaciais.







