Termoquímica
Termoquímica é o ramo da química que se dedica a estudar as transformações físicas e químicas ocasionadas pela liberação ou absorção de calor. Nessa área estudamos todas as questões envolvidas na perda ou ganho de calor, forma de energia presente nas reações químicas.
A presença ou ausência de calor também influencia nas transformações físicas entre os estados sólido, líquido e gasoso.
Dizemos que quando uma substância passa do estado sólido para o líquido e em seguida para o estado gasoso, ocorre absorção de calor. E quando a substância passa do estado gasoso para líquido e em seguida para o estado sólido, acontece a liberação de calor.
Na termoquímica temos o conceito de Entalpia, energia presente nas reações químicas e decorrente de rearranjos entre as ligações químicas dos reagentes. Essa energia armazenada é representada pela letra maiúscula H.
A variação de entalpia (ΔH) é alcançada pela diferença entre a entalpia dos produtos e a entalpia dos reagentes. O objetivo da Termoquímica é exatamente o de estudar o calor da reação provocada pela troca de energia entre o meio externo e os reagentes.
O cálculo da Entalpia é a forma mais comum de expressar o conteúdo calorífico de um elemento dentro de uma reação química.
Vale lembrar ainda que as reações que liberam calor para o ambiente externo são chamadas reações exotérmicas. E as reações que absorvem calor do meio externo são chamadas reações endotérmicas.
Reações Exotérmicas » São aquelas que liberam calor ao ambiente. Exemplo: Combustão da madeira.
Reações Endotérmicas » São aquelas que absorvem calor do ambiente. Exemplo: Fusão do gelo.
Variação de Entalpia »
Exotérmica: A + B ——–> C + D + CALOR.
Passando o CALOR para o primeiro membro, ficará assim: A + B – CALOR ——> C + D. Você observa que os reagentes perdem calor, logo a reaçãoé exotérmica.
Endotérmica: X + Y ——–> Z – CALOR.
Passando o CALOR para o primeiro membro, ficará assim:
X + Y + CALOR ——>Z. Você observa que os reagentes
absorvem calor, logo a reação é endotérmica.
* DH = Variação de entalpia = Diferença entre o conteúdo energético dos produtos pelo conteúdo energético dos reagentes. DH = HP – HR.
* DH < 0 : Reação Exotérmica.

Note que HR > HP, logo DH < 0.
* DH > 0 : Reação Endotérmica.
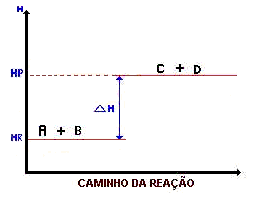
Note que HP > HR, logo DH > 0.







