Leis Ponderais
Durante o século XVIII, aconteceu um grande avanço no mundo da Química, fazendo com que ela se tornasse uma ciência bem fundamentada e os cientistas passaram a incluir o método científico nos seus estudos.
Através de estudos detalhados, aprofundados, com experiências cuidadosas, algumas importantes leis foram sendo introduzidas, de modo que conseguiam explicar como as reações químicas aconteciam, e como as substâncias se mantinham de forma regular de um modo geral.
Entre essas leis, encaixam-se as leis ponderais, que eram as leis que relacionavam as massas dos participantes de uma reação química.
Nas Leis Ponderais estão inclusas três leis, a “Lei de Proust”, a “Lei de Lavoisier” e a “Lei de Dalton”. Essas leis contribuíram de forma significativa para o avanço da Química como ciência, de forma que introduziram o método científico.
As Leis Ponderais foram essenciais para os estudos da estequiometria e de outras teorias que foram postuladas posteriormente. Elas estão relacionadas com as massas dos elementos químicos dentro das reações químicas.

Lei de Lavoisier (Lei da conservação da massa)
A Lei de Lavoisier é chamada de “Lei de Conservação de Massas” e foi introduzida pelo químico francês Antoine Laurent Lavoisier. Seu lema é:
“A soma das massas das substâncias reagentes em um recipiente fechado é igual à soma das massas dos produtos da reação”.
Hoje em dia, essa frase pode ser aplicada pelo seguinte enunciado: “Na natureza, nada se cria, nada se forma, tudo se transforma”. Essa frase foi baseada na célebre frase do Lavoisier, inspirada em sua Conservação de Massas, pois o químico descobriu que nas reações químicas os elementos não desaparecem, eles apenas são rearranjados e transformados em outros.
A experiência feita por Lavoisier resultou na transformação do Mercúrio (Hg) em contato com o Oxigênio (O), resultando no Óxido de Mercúrio II (HgO).
Feita dessa forma essa equação:
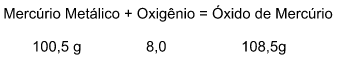
Com isso, Lavoisier fez vários experimentos, analisando as massas dos reagentes e dos produtos das reações químicas, o que o levou a descobrir que as massas dos elementos envolvidos, após entrarem em reação, são constantes, ou seja, a reação permaneceu com a mesma massa inicial.
Importante salientar que a Lei de Lavoisier só é aplicada em recipientes fechados.
Lei de Proust (Lei das proporções fixas)
Essa lei é conhecida como “Lei de Proporções Constantes” e foi descoberta pelo químico francês Joseph Louis Proust. Seu lema é:
“Uma determinada substância composta é formada por substâncias mais simples, unidas sempre na mesma proporção em massa.”
Sendo assim, Proust realizou diversas experiências e constatou que as massas dos elementos envolvidos nas reações químicas são proporcionais. Com isso, é explicado o número da massa dos elementos químicos e as suas proporcionalidades. Ou seja, algumas substâncias sempre irão reagir com outras substâncias, a partir de uma proporção definida de massas envolvidas.
Importante ressaltar que as massas dos elementos envolvidos podem sofrer alteração, entretanto, a proporção entre elas será sempre a mesma. Com isso, conclui-se que se a massa de um elemento da reação química é duplicada, os outros também serão.
Isso explica o processo de balanceamento das reações químicas e os cálculos estequiométricos.
Lei de Dalton (Lei das proporções múltiplas)
Quando duas substâncias simples reagem entre si para formar compostos diferentes, se a massa de uma delas permanecer constante, a massa da outra substância irá variar numa relação de números inteiros e pequenos. [ John Dalton (1766-1844)]



