Modelos Atômicos
Resumo de Modelos Atômicos
Os modelos atômicos foram estudados e propostos com o objetivo de divulgar a constituição da matéria. O conceito de átomo foi determinado por volta de 1650 d.C., proposto pelo filósofo francês Pierre Cassendi.
Já a “Teoria atômica” foi proposta por John Dalton após experimentos sobre gases e reações químicas. Os modelos atômicos são a base de teorias fundamentadas em experimentações realizadas por vários cientistas até chegarmos ao modelo atômico aceito na atualidade.
Conheça os principais Modelos Atômicos da história:
1. Modelo Atômico de Dalton – John Dalton, cientista e professor britânico, propôs em 1808, uma explicação para a constituição da matéria. Segundo a teoria de Dalton, “toda matéria é composta por minúsculas partículas chamadas átomos. Os átomos de um determinado elemento são idênticos em massa e apresentam as mesmas propriedades químicas. E os compostos são formados pela combinação de átomos de elementos diferentes em proporções fixas”.
2. Modelo Atômico de Thomson – J.J. Thomson estudou os raios catódicos e propôs um modelo atômico. Para ele, os raios podiam ser interpretados como feixes de partículas carregadas de energia elétrica negativa, os chamados elétrons. Assim, os elétrons seriam constituintes de todo tipo de matéria. Segundo Thomson, o átomo seria um aglomerado de partículas positivas pesadas (prótons) e de partículas negativas (elétrons).
3. Modelo Atômico de Rutherford – O modelo atômico de Ernest Rutherford foi proposto em 1911, após estudos sobre a trajetória das partículas emitidas pelo polônio. Para ele, os átomos seriam formados por um núcleo pequeno carregado positivamente e rodeado por uma grande região repleta de elétrons.
4. Modelo Atômico Clássico – Segundo esse modelo, o núcleo, preenchido de prótons e nêutrons, seria rodeado por uma eletrosfera, onde estariam os elétrons girando ao redor do núcleo.
Modelo Atômico Rutherford-Bohr – Bohr aperfeiçoou o modelo atômico de Rutherford e propôs que na eletrosfera, os elétrons descrevem órbitas circulares ao redor do núcleo, cada camada ocupada por um elétron possui um valor determinado de energia, cada órbita recebe o nome de estado estacionário e pode ser designada pelas letras K, L, M, N, O, P, Q, formando camadas.
HISTÓRIA DO ÁTOMO
No século V a.C., o filósofo grego Demócrito imaginou a matéria constituída por pequenas partículas indivisíveis – átomos. Só muito mais tarde, no séc. XVII é que é confirmada a existência do vazio.
MODELO DE DEMÓCRITO
Por volta de 400 anos a.C. filósofo grego Demócrito sugeriu que a matéria não é contínua, isto é, ela é feita de minúsculas partículas indivisíveis. Essas partículas foram chamadas de átomos (a palavra átomo significa, em grego, indivisível).
Demócrito postulou que todas as variedades de matéria resultam da combinação de átomos de quatro elementos: terra, ar, fogo e água.
Demócrito baseou seu modelo na intuição e na lógica. No entanto foi rejeitado por um dos maiores lógicos de todos os tempos, o filosofo Aristóteles. Este reviveu e fortaleceu o modelo de matéria contínua, ou seja, a matéria como “um inteiro”.
Os argumentos de Aristóteles permaneceram até a Renascença.
MODELO DE DALTON
Todo modelo não deve ser somente lógico, mas também consistente com a experiência. No século XVII, experiências demonstraram que o comportamento das substâncias era inconsistente com a idéia de matéria contínua e o modelo de Aristóteles desmoronou.
Em 1808, John Dalton, um professor inglês, propôs a idéia de que as propriedades da matéria podem ser explicadas em termos de comportamento de partículas finitas, unitárias. Dalton acreditou que o átomo seria a partícula elementar, a menor unidade de matéria.
Surgiu assim o modelo de Dalton: átomos vistos como esferas minúsculas, rígidas e indestrutíveis. Todos os átomos de um elemento são idênticos.
MODELO DE THOMSON (Modelo do Pudim de Passas)
Em 1987, o físico inglês J.J. Thomson demonstrou que os raios catódicos poderiam ser interpretados como um feixe de partículas carregadas que foram chamadas de elétrons. A atribuição de carga negativa aos elétrons foi arbitrária.
Thomson concluiu que o elétron deveria ser um componente de toda matéria, pois observou que a relação e/m para os raios catódicos tinha o mesmo valor, qualquer que fosse o gás colocado na ampola de vidro.
Em 1989, Thomson apresentou o seu modelo atômico: uma esfera de carga positiva na qual os elétrons, de carga negativa, estão distribuídos mais ou menos uniformemente. A carga positiva está distribuída, homogeneamente, por toda a esfera.
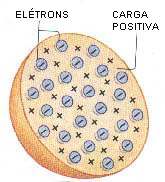
MODELO DE RUTHERFORD
Em 1911, Rutherford e colaboradores (Geiger e Marsden) bombardearam uma lâmina metálica delgada com um feixe de partículas alfa atravessava a lâmina metálica sem sofrer desvio na sua trajetória (para cada 10.000 partículas alfa que atravessam sem desviar, uma era desviada). Para explicar a experiência, Rutherford concluiu que o átomo não era uma bolinha maciça.
Admitiu uma parte central positiva muito pequena mas de grande massa (“o núcleo”) e uma parte envolvente negativa e relativamente enorme (“a eletrosfera ou coroa”).
Se o átomo tivesse o tamanho do Estádio do Morumbi, o núcleo seria o tamanho de uma azeitona. Surgiu assim o modelo nuclear do átomo.
O modelo de Rutherford é o modelo planetário do átomo, no qual os elétrons descrevem um movimento circular ao redor do núcleo, assim como os planetas se movem ao redor do sol.
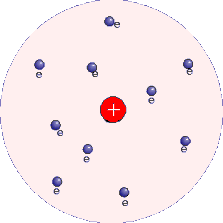
MODELO DE BOHR
O modelo planetário de Rutherford apresenta duas falhas:
Uma carga negativa, colocada em movimento ao redor de uma carga positiva estacionária, adquire movimento espiralado em sua direção acabando por colidir com ela. Essa carga em movimento perde energia, emitindo radiação. Ora, o átomo no seu estado normal não emite radiação.
Em 1913, o físico dinamarquês Niels Bohr expôs uma idéia que modificou o modelo planetário do átomo.
Um elétron num átomo só pode ter certas energias específicas, e cada uma destas energias corresponde a uma órbita particular. Quanto maior a energia do elétron, mais afastada do núcleo se localiza a sua órbita.
Se o elétron receber energia ele pula para uma órbita mais afastada do núcleo.
Por irradiação de energia, o elétron pode cair numa órbita mais próxima do núcleo. No entanto, o elétron não pode cair abaixo de sua órbita normal estável.
Mais tarde, Sommerfeld postulou a existência de órbitas não só circulares mas elípticas também.
Autores:
Carlos Alberto de Souza
Ivan Gonçalves da Silva
Fonte:
http://educar.sc.usp.br/licenciatura/2001/modeloatomico/modelos_atomicos.html







