Tabela Periódica
A primeira tabela periódica aceita pelos químicos foi o modelo de Dmitri Mendeleev, em 1869.
História da tabela periódica
A tabela periódica é uma ferramenta de estudo da química que apresenta todos os elementos conhecidos pelo homem. Ela é uma excelente fonte de informação e conta com características sobre os elementos químicos.
A história da construção da tabela periódica começa com muita discussão e estudo científico. Os primeiros modelos de tabela foram criados em 1817, a partir da “lei das tríades”, de Johann Wolfgang Döbereiner. O cientista estabeleceu uma primeira disposição sistemática de alguns elementos. Em seguida, Dmitri Mendeleev e Lothar Meyer organizaram a tabela de elementos químicos demonstrando a periodicidade dos mesmos.
Muitas teorias foram usadas para criar o modelo ideal da tabela periódica. O trabalho de Antoine Lavoisier, que incluiu a organização de uma lista com os elementos, também contribuiu para a apresentação final da tabela.
Com o passar dos anos, houve um aumento do número de elementos descobertos, e os cientistas começaram a discutir os modelos para reconhecer as propriedades e as classificações de cada elemento. O primeiro modelo organizado com todos os elementos foi o parafuso telúrico de Chancourtois, mas a primeira tabela com aceitação geral entre os químicos foi realmente a de Dmitri Mendeleev, em 1869. Esta versão da tabela foi aprimorada ao longo dos anos até chegar ao formato que usamos hoje.
Classificação Periódica dos Elementos
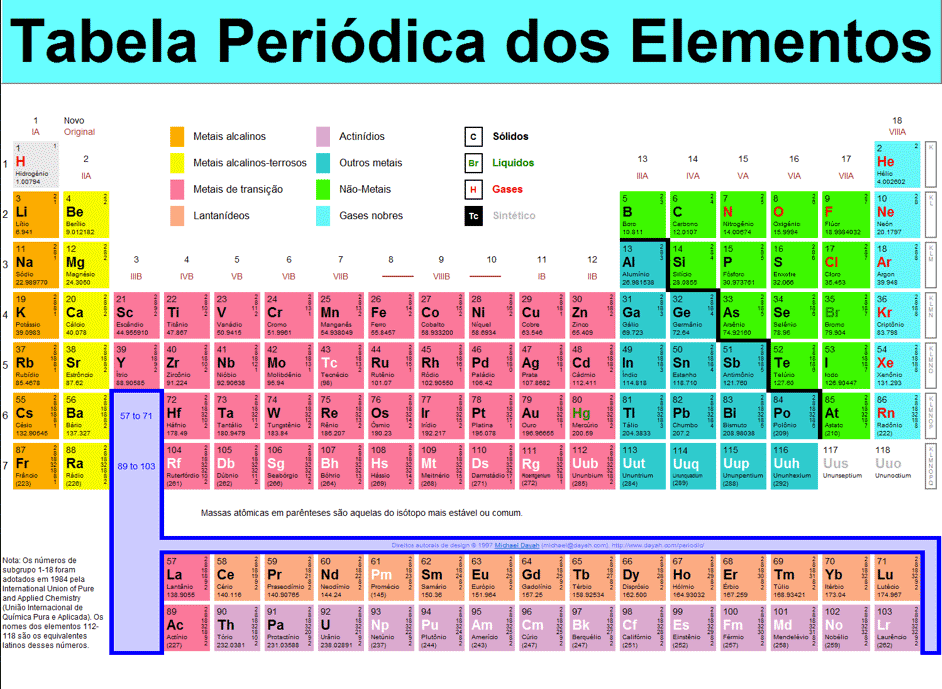
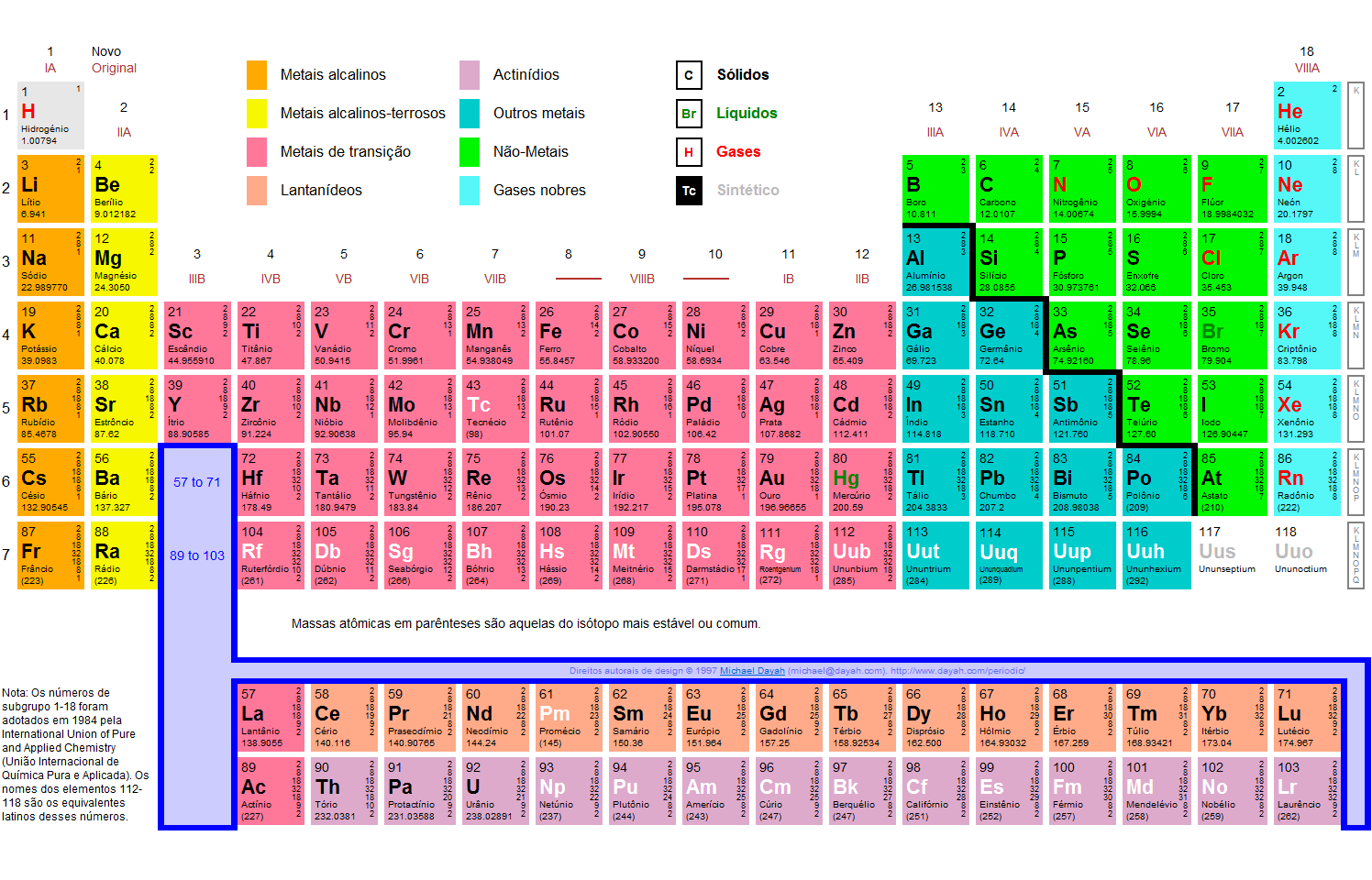
No mundo da química, são cinco os tipos de eles químicos encontrados na Tabela periódica: metais, ametais, semimetais, gases nobres e hidrogênio. Essa classificação fica melhor definida quando é visualizada na Tabela Periódica, onde estes todos separados por cores, conforme mostra a figura abaixo:
Entendendo melhor os componentes da Tabela Periódica
Para melhor entender a Tabela Periódica, é preciso uma definição dos elementos que a compõe. Para isso, serão classificados os cinco grupos, contendo neles as características de cada um, para que saibamos diferenciá-los e conhecê-los.
São eles:
Metais
São os elementos mais presentes na Tabela. Correspondem a dois terços dela e, como podemos ver acima, estão representados pela cor amarela. No total, são 87 elementos.
Sua principal característica é, em contato com a temperatura ambiente, mantêm-se sólidos. Apenas o Mercúrio (Hg), não entra nesse quesito. Os metais são condutores de calor e eletricidade. Outra característica importante é que os metais possuem uma capacidade para serem moldados, além de serem utilizados na formação de fios, como os de cobre, muito utilizados na transmissão de energia elétrica. Possui um brilho metálico característico.
Os metais que pertencem às duas primeiras famílias ou grupos, 1A e 2ª são denominados, respectivamente, como metais alcalinos e metais alcalino terrosos.
Esses grupos são divididos em três partes:
- Metais representativos, típicos ou característicos: os 19 elementos que pertencem às colunas A;
- Metais de transição: 32 elementos que estão nas colunas B;
- Metais de transição interna: 26 elementos da família dos Lantanídeos e dos Actinídeos;
- 10 metais que não estão em nenhum desses grupos.
Ametais
São os 11 elementos que aparecem na Tabela representados pela cor roxa: Carbono (C), Nitrogênio (N), Fósforo (P), Oxigênio (O), Enxofre (S), Selênio (Se), Flúor (F), Cloro (Cl), Bromo (Br), Iodo (I) e Astato (At).
Esses elementos são contrários às ações dos metais, isso significa que não são bons condutores de energia elétrica, nem de calor. Porém, a maioria deles funcionam como isolantes, não possuem brilho algum característico e se dividem em partes. A exceção para esses dois casos é a Grafita (Cn(s)) e, do Iodo (I2(S)), que possui um brilho específico.
Semimetais
Essa nomeação já está em desuso, desde que a União Internacional de Química Pura e Aplicada (IUPAC) não reconhece mais, desde 1986. Porém, muitas Tabelas ainda são encontradas com essa nomenclatura, pois possuem características que ficam entre os metais e os ametais.
São encontrados na Tabela representados pela cor rosa. São 7 elementos: Germânio (Ge), Antimônio (Sb) e o Polônio (Po), classificados como metais e os elementos Boro (Bo), Silício (Si), Arsênio (As) e Telúrio (Te), os não metais.
Gases Nobres
Estão representados na Tabela pela família 18 ou 8A, na cor azul, sendo 6 elementos: Hélio (He), Neônio (Ne), Argônio (Ar), Criptônio (Kr), Xenônio (Xe) e Radônio (Rn).
São elementos gasosos na temperatura ambiente e são encontrados na natureza de forma isolada, se mantendo mais estáveis. Além disso, eles não têm composição com outros elementos.
Hidrogênio
Este elemento não se enquadra em nenhum grupo da Tabela Periódica. Em algumas tabelas pode ser encontrado na família dos alcalinos, devido o seu número de elétron na sua camada de valência, sendo essa, a sua única camada. Porém, não possui característica alguma parecida com outros elementos dessa família.
O hidrogênio é o elemento mais abundante do universo, pois pode combinar com os metais, ametais e semimetais. É um gás inflamável encontrado nas camadas da atmosfera ou em combinação com outros elementos.
Leia também:
Os novos elementos da tabela periódica