Destilação Fracionada
A destilação fracionada é um processo químico realizado para separar misturas homogêneas. O trabalho pode ser feito para a separação de 2 ou mais gases ou líquidos que possuem pontos de ebulição aproximados. Por isso, a destilação fracionada é indicada para substâncias que volatilizam praticamente no mesmo momento.
A destilação fracionada pode ser usada para separar misturas em pequenas quantidades ou em larga escala, em laboratórios de experimentação ou em volume industrial. Para cada caso é necessário contar com um equipamento específico.
Como acontece a destilação fracionada?
Para ocorrer a destilação fracionada, é preciso realizar o aquecimento da mistura homogênea. Conforme o ponto de ebulição da substância, ela será volatilizada e passará pela coluna de fracionamento. Logo depois, é direcionada para um condensador, onde o vapor se transforma em líquido novamente, quando entra em contato com uma superfície fria.
Para o processo ter sucesso é necessário reparar na temperatura de ebulição das substâncias que estão contidas na mistura. Assim, a separação se dá através do fracionamento dos componentes.
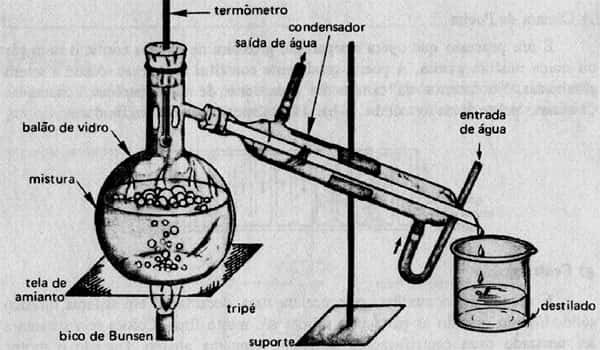
Exemplo de destilação fracionada
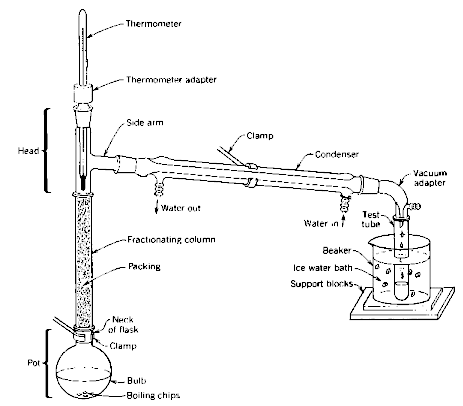
Um dos processos de destilação fracionada mais conhecidos que existe é o craqueamento de petróleo. A mistura é formada por hidrocarbonetos e compostos inorgânicos.
A destilação fracionada é feita com o suporte da torre de destilação. Os compostos originários do petróleo assumem estado gasoso (vapor). Quando chegam ao ponto de ebulição, os compostos que estão no petróleo ficam volatilizados e chegam até a coluna de fracionamento.
Depois, há o resfriamento e a condensação para que seja feita a coleta do componente, que será usado para outra finalidade. A destilação do petróleo gera uma série de compostos com os quais estamos acostumados:
- Gás Metano
- Gás Butano
- Gás Propano
- Naftas
- Gasolina
- Querosene
- Óleo Diesel
- Óleos lubrificantes
- Óleos combustíveis
- Asfalto
- Betume
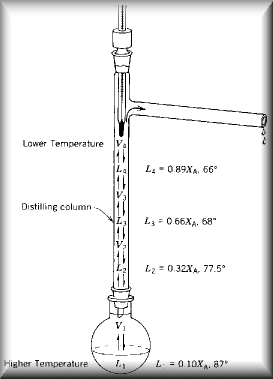
As refinarias de petróleo se encarregam de fazer a destilação fracionada.
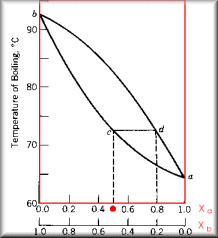
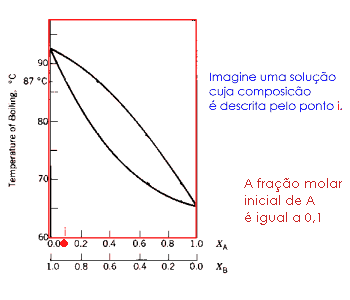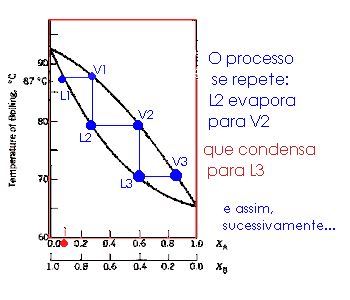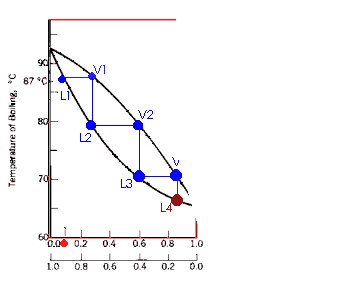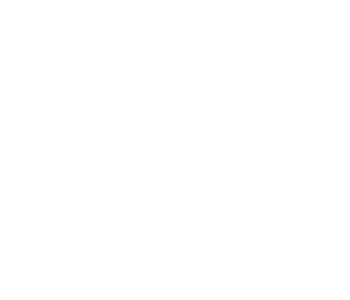
Ilustração da destilação de sucessivas frações, simplificando, esta é a destilação fracionada.
Quais são os tipos de coluna de destilação?
Existem alguns modelos de coluna de destilação e suas aplicações específicas. A seguir estão as mais comuns:
Hempel
Trata-se de um tubo com vedação feita com cobre ou aço inox. Seu interior também é feito com metal, geralmente o aço inox.
Vigreux
São colunas com formato de 45°, que ficam colocadas em pares em posição oposta. É muito comum em laboratórios, geralmente usado em aulas de química.
Dufton
Tubo com vedação metálica, em sua parte interna possui gotas e glass beads (vidros em secções).
Veja também:







