Compostos Inorgânicos
Os compostos inorgânicos são quaisquer substâncias formadas por átomos ou moléculas de pelo menos dois elementos químicos diferentes e que não contenha em sua estrutura átomos de carbono formando cadeias e ligados ao hidrogênio.
Os compostos com um átomo de carbono são chamados compostos orgânicos, devido à sua base de raiz em um átomo que é vital para a vida.
Há um pequeno número de compostos inorgânicos que realmente contém carbono, dada sua propensão para formar ligações moleculares, estes incluem monóxido de carbono e dióxido de carbono, por exemplo. Esses compostos são chamados de inorgânicos porque são originados de minerais que não são coisas vivas ou chamadas orgânicas.
Compostos inorgânicos são bastante simples, pois não formam as complexas ligações moleculares que o carbono torna possível. Um exemplo comum de um composto inorgânico simples seria o cloreto de sódio, mais conhecido como sal doméstico. Este composto contém apenas dois átomos, sódio (Na) e cloro (Cl).
Os compostos inorgânicos podem ser formados por qualquer elemento da Tabela Periódica, mas geralmente são feitos de ametais ou de hidrogênio e tem ligações com átomos metálicos.
Quanto à ligação, eles podem ser iônicos, covalentes ou de coordenação e são divididos em ácidos, sais, bases e óxidos.
Ácidos, sais, bases e óxidos
Ácidos: os ácidos são todas as substâncias que em solução aquosa libera, como único cátion, o íon H+. Eles são divididos em hidrácidos e oxiácidos. Exemplos: H2SO4, HCN E NaOH.
Sais: é toda substância que, em solução aquosa, sofre dissociação, liberando pelo menos um cátion diferente do H+ e um ânion diferente do OH-. Exemplos: NaCL, Na2SO4, FeCl3.
Bases: as bases também são chamadas de hidróxidos e é toda substância que em solução aquosa liberar, como único ânion, o íon OH- (hidroxila). Exemplos: NaOH, Ca(OH)2, Al (OH)3.
Óxidos: os óxidos são compostos binários que são formados por apenas dois elementos aonde o oxigênio é o mais eletronegativo. Exemplos: CO2, SO3, Na2O.
Exemplos de Compostos Inorgânicos
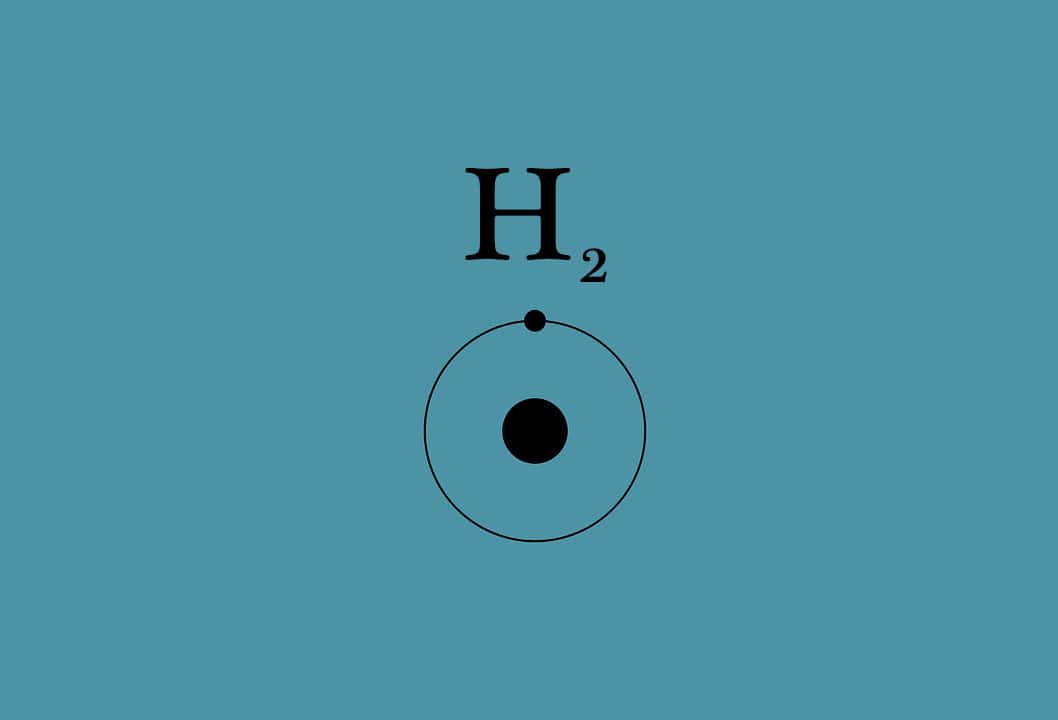
1. H2O – A água é um composto inorgânico simples, embora contenha hidrogênio, um átomo chave (junto com o carbono) em muitos compostos orgânicos. Os átomos de uma molécula de água formam ligações muito simples devido a essa falta de carbono.
2. HCl – Cloridrato, também conhecido como ácido clorídrico quando é dissolvido em água, é um ácido incolor e corrosivo com um pH bastante forte. É encontrado nos sucos gástricos de muitos animais, ajudando na digestão ao quebrar os alimentos.
3. CO2 – O dióxido de carbono, apesar da presença de um átomo de carbono na fórmula, é classificado como um composto inorgânico. Isso causou uma disputa dentro da comunidade científica, com questões levantadas quanto à validade de nossos métodos atuais de classificação de compostos. Atualmente, compostos orgânicos contêm um carbono ou um hidrocarboneto, que forma uma ligação mais forte. A ligação formada pelo carbono em CO 2 não é uma ligação forte.
4. NO2 – O gás de dióxido de nitrogênio apresenta uma variedade de cores em diferentes temperaturas. É frequentemente produzido em testes nucleares atmosféricos. É altamente tóxico e forma ligações bastante fracas entre os átomos de nitrogênio e oxigênio.
5. Fe2O3 – O óxido de ferro (III) é um dos três principais óxidos de ferro e é um composto inorgânico devido à falta de um átomo de carbono ou de um hidrocarboneto. O óxido de ferro (III) ocorre naturalmente como hematita e é a fonte da maior parte do ferro para a indústria de produção de aço. É conhecido como ferrugem e compartilha várias características com sua contraparte natural.
Veja também:
Compostos Orgânicos
Química Orgânica
Tabela Periódica